O prazo para atendimento da RDC 591/2021 que trata da identificação de dispositivos médicos regularizados pela Anvisa, por meio do sistema de Identificação Única de Dispositivos Médicos (UDI), para produtos de classe de risco IV está próximo!
Por esse motivo, vamos relembrar o que é UDI, o que deve ser feito de acordo com a RDC 591/2021 e quais ações imediatas devem ser tomadas para garantir a identificação precisa e a rastreabilidade ao longo de toda sua cadeia de suprimentos.
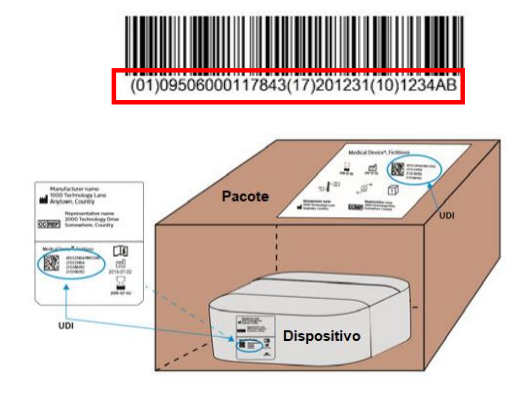
O UDI é uma sequência de caracteres numéricos ou alfanuméricos criada através de normas de identificação e codificação de dispositivos aceitos a nível mundial. Permite a identificação inequívoca de um dispositivo específico no mercado. O Sistema de identificação única de dispositivos médicos destina-se a fornecer uma identificação única, harmonizada globalmente, para a identificação de dispositivos médicos durante sua distribuição e uso.
Conforme o artigo 15 da RDC, existem 4 ações a serem realizadas pelas empresas:
Ações 1 e 2: Fique atento aos níveis de embalagem que o UDI deve ser incluído, conforme a RDC 591/21.
A empresa deve assegurar que as informações contidas no UDI permaneçam legíveis ao longo de toda a vida útil do produto e que as etiquetas estejam adequadamente fixadas.
Para as ações 3 e 4 ainda se faz necessária a publicação de instruções normativas, porém, conforme consulta realizada pelo Grupo Vera Rosas em 02/2024, a ANVISA ainda não tem previsão para publicação dessas instruções, uma vez que dependem da finalização do sistema UDI (plataforma para submissão dos dados), que encontra-se em desenvolvimento pela equipe de TI da Anvisa.
Até julho de 2024 as duas primeiras ações acima devem ser realizadas para os dispositivos médicos de classe de risco IV. Ou seja, para esses produtos, o UDI já deve estar presente nas embalagens.
Além disso, como já praticado, no caso de stents para artérias coronárias, stents farmacológicos para artérias coronárias, e implantes para artroplastia de quadril e de joelho, o fabricante ou detentor da regularização deve assegurar o fornecimento do suporte da UDI na etiqueta de rastreabilidade.
Nossos especialistas estão aptos a orientar e apoiar sua empresa neste processo.
Entre em contato:
📱+55 (11) 3889-0875
Enviamos em seu e-mail nossas notícias, eventos, comunicados filtrando apenas os assuntos e categorias que você escolhe receber.
+55 11 3889 0875
comercial@verarosas.com.brRua Batataes, 376
Jardim Paulista - São Paulo/SP